
Innehållsförteckning:
- Författare Stanley Ellington ellington@answers-business.com.
- Public 2023-12-16 00:23.
- Senast ändrad 2025-06-01 04:55.
A 510(k ) är en inlämning som innehåller information som krävs enligt 21 CFR 807.87. För mer information om det regelverk, policyer och praxis som ligger till grund för FDA:s 510(k ) recension, se vägledningen The 510(k ) Program: Utvärdering av väsentlig likvärdighet i meddelande före marknadsföring [ 510(k )].
Förutom detta, vad är en 510k-fil?
A 510(K ) är en förmarknad underkastelse gjord till FDA för att visa att enheten som ska marknadsföras är minst lika säker och effektiv, det vill säga i stort sett likvärdig med en lagligt marknadsförd enhet (21 CFR §807.92(a)(3)) som inte är föremål för godkännande från förhandsmarknaden. Läs mer Sök i databasen. Hjälp att ladda ner filer. 510K
På samma sätt, vad är en speciell 510k? Special 510(k )s tillåter FDA och industrin att förlita sig på byråns tidigare granskning av detaljerad information, där så är lämpligt, utan att ändra några lagstadgade eller regulatoriska krav relaterade till förmarknadsanmälan enligt avsnitt 510 och 513 i FD&C Act, och 21 CFR 807 kapitel E.
Därav, hur förbereder man en 510 K?
Till att börja med, här är en lista över alla avsnitt som krävs för en 510(k)-inlämning:
- Grupp 1 - Försättsbladsformulär.
- Grupp 2 - Vad andra kan se.
- Grupp 3 - Mallsektioner.
- Grupp 4 - Jämför din produkt kontra predikat(er)
- Grupp 5 - Säkerställa patientsäkerhet.
- Grupp 6 - Programvara och elektronik.
- Grupp 7 - Prestandatestning.
Vad är skillnaden mellan 510k och PMA?
A PMA är mer djupgående än en 510k - den används för att bevisa att en ny enhet är säker och effektiv för slutanvändaren och kräver vanligtvis kliniska prövningar med mänskliga deltagare tillsammans med laboratorietester.
Rekommenderad:
Vad är ett alternativ till ett kvävebaserat gödselmedel?
Det finns flera alternativ till kemiskt gödningsmedel som finns på de flesta trädgårdscenter och växthus som använder naturmaterial för att berika din jord. Benmjöl. Bomullsfrömjöl. Alfalfa pellets. Fladdermus Guano. Fiskemulsioner. Komposterad gödsel
Vad är skillnaden mellan ett cinderblock och ett cementblock?

Cinder block är tillverkad av betong och kol cinder. Betongblock tillverkas av stål, trä och cement. Cinder block är lättare än betongblock. Ett betongblock innehåller sten eller sand vilket gör det tyngre
Vad är namnet på den del av ett enzym som ett substrat binder till?
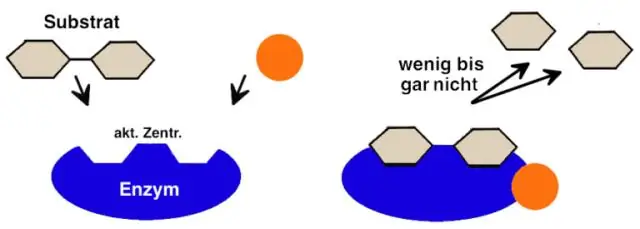
Inom biologi är den aktiva platsen den region av ett enzym där substratmolekyler binder och genomgår en kemisk reaktion. Det aktiva stället består av rester som bildar tillfälliga bindningar med substratet (bindningsställe) och rester som katalyserar en reaktion av det substratet (katalytiskt ställe)
Vad är ett exempel på ett mikrosystem?

Mikrosystem inkluderar barnets familj, skola, kamrater och grannskap. Mikrosystem inkluderar också sport och aktiviteter, till exempel karateklasser eller Girl Scouts. Mikrosystemet innehåller dubbelriktade relationer. Till exempel kan ett barn aktivt bilda sociala relationer med andra barn i balettklass
Vad är ett projekt och vad är inte ett projekt?

Det som i grund och botten inte är ett projekt är den pågående processen, business as usual-verksamheten, tillverkning, definierade start- och slutdatum, spelar ingen roll om det är dagar eller år, men det förväntas avslutas inom en viss tidpunkt för att helt och hållet leverera det som var projektgruppen som arbetar med
